तत्वों का आवर्त वर्गीकरण
प्रश्न 1. क्या डोबेराइनर के त्रिक, न्यूलैण्ड के अष्टक के स्तम्भ में भी पाए जाते हैं? तुलना करके पता कीजिए।
उत्तर:- हाँ, पाए जाते हैं।
प्रश्न 2.डोबेराइनर के वर्गीकरण की क्या सीमाएँ हैं?
उत्तर:- डोबेराइनर के वर्गीकरण की सीमाएँ-डोबेराइनर केवल तीन ही त्रिक बना सके, अन्य तत्वों का वर्गीकरण त्रिकों में नहीं हुआ।
प्रश्न 3. न्यूलैण्ड के अष्टक सिद्धान्त की क्या सीमाएँ हैं?
उत्तर:- न्यूलैण्ड के अष्टक सिद्धान्त की सीमाएँ:
- यह सिद्धान्त भारी तत्वों पर लागू नहीं था।
- अक्रियशील उत्कृष्ट गैसों को सम्मिलित करने पर अष्टक सिद्धान्त मेल नहीं खाता।
- कुछ असमान तत्वों को एक साथ रख दिया गया है।
- यह सिद्धान्त केवल कैल्सियम तक लागू होता है।
प्रश्न श्रृंखला-2 # पृष्ठ संख्या 94
प्रश्न 1.मैण्डलीफ की आवर्त सारणी का उपयोग कर निम्नलिखित तत्वों के ऑक्साइड के सूत्र का अनुमान कीजिए –
K, C, Al, Si, Ba
उत्तर: ऑक्साइड O की संयोजकता 6 – 8 = – 2 है।
उत्तर:
- स्कैण्डियम।
- जर्मेनियम।
उत्तर:- मैण्डलीफ ने अपनी आवर्त सारणी तैयार करने के लिए तत्वों के परमाणु द्रव्यमान एवं उनके भौतिक तथा रासायनिक गुणों की आवर्तता का मापदण्ड अपनाया।
उत्तर:- चूँकि उत्कृष्ट गैसें अक्रियाशील हैं तथा प्रकृति में ये केवल वायुमण्डल में बहुत कम मात्रा में पाई जाती हैं। इनका पता आवर्त सारणी के बनने के बाद चला तथा ये अन्य तत्वों से सर्वदा भिन्न थीं इसलिए आवर्त सारणी को छेड़े बिना इन्हें अलग समूह में रखा गया।
उत्तर:- आधुनिक सारणी में आधार परमाणु द्रव्यमान के स्थान पर परमाणु क्रमांक को माना गया तथा इसका दीर्घ रूप होने से मैण्डलीफ की आवर्त सारणी की विसंगतियाँ प्रायः दूर हो गईं।
उत्तर:
- कैल्सियम।
- स्ट्रॉन्शियम।
- तीन तत्वों जिनके सबसे बाहरी कोश में एक इलेक्ट्रॉन हो।
- दो तत्वों जिनके के सबसे बाहरी कोश में दो इलेक्ट्रॉन हों।
- तीन तत्वों जिनका बाहरी कोश पूर्ण हों।
1.
• लीथियम (Li)।
• सोडियम (Na)।
• पोटैशियम (K)।
2.
• मैग्नीशियम (Mg)।
• कैल्सियम (Ca)।
3.
• हीलियम (He)।
• निऑन (Ne)।
• आर्गन (Ar)।
हीलियम एक अक्रियाशील गैस है, जबकि निऑन की अभिक्रियाशीलता अत्यन्त कम है। इनके परमाणुओं में कोई समानता है?
उत्तर:
• इनके परमाणुओं के बाह्यतम कोश में एक-एक इलेक्ट्रॉन हैं।
• इनके परमाणुओं के बाह्यतम कोश संतृप्त हैं।
उत्तर:- पहले दस तत्वों में लीथियम (Li) एवं बेरीलियम (Be) दो धातुएँ हैं।
उत्तर: Be.
पाठान्त अभ्यास के प्रश्नोत्तर
(a) तत्वों की धात्विक प्रकृति घटती है।
(b) संयोजकता इलेक्ट्रॉनों की संख्या बढ़ जाती है।
(c) परमाणु आसानी से इलेक्ट्रॉन का त्याग करते हैं।
(d) इनके ऑक्साइड अधिक अम्लीय हो जाते हैं।
उत्तर:- (c) परमाणु आसानी से इलेक्ट्रॉन का त्याग करते हैं।
(a) Na
(b) Mg
(c) Al
(d) Si
उत्तर:- (b) Mg
- किस दो कोश हैं तथा दोनों इलेक्ट्रॉनों से पूरित हैं?
- इलेक्ट्रॉन विन्यास 2, 8, 2 है?
- कुल तीन कोश हैं तथा संयोजकता कोश में चार इलेक्ट्रॉन हैं।
- कुल दो कोश हैं तथा संयोजकता कोश में तीन इलेक्ट्रॉन हैं।
- दूसरे कोश में पहले कोश से दो गुने इलेक्ट्रॉन हैं।
- निऑन (Ne)।
- मैग्नीशियम (Mg)।
- सिलिकॉन (Si)।
- बोरॉन (B)।
- कार्बन (C)।
(b) आवर्त सारणी में फ्लुओरीन के स्तम्भ के सभी तत्वों के कौन-से गुणधर्म समान हैं?
(a)
- इन सभी तत्वों के बाह्यतम कोश में तीन संयोजी इलेक्ट्रॉन हैं।
- ये सभी तीन इलेक्ट्रॉन त्यागकर तीन धनावेशों युक्त धनायन बनाते हैं।
- ये सभी त्रिसंयोजक हैं।
- सभी तत्वों के बाह्यतम कोश में सात इलेक्ट्रॉन हैं।
- सभी तत्व एक इलेक्ट्रॉन ग्रहण करके एक इकाई आवेशयुक्त ऋणायन बनाते हैं।
- सभी हैलोजेन कहलाते हैं तथा धातुओं के हैलाइड बनाते हैं।
- सभी हाइड्रोजन से संयुक्त होकर हैलोजेनिक अम्ल बनाते हैं।
- इस तत्व की परमाणु संख्या क्या है?
- निम्नलिखित में किस तत्व के साथ इसकी रासायनिक समानता होती है? (परमाणु संख्या कोष्ठक में दी गई है।): N (7), F (9), P(15), Ar (18)।
- परमाणु संख्या = 17 है।
- F(9) जहाँ 9 = 2, 7
(a) A धातु है या अधातु।
(b) A की अपेक्षा C अधिक अभिक्रियाशील है या कम।
(c) C का साइज B से बड़ा होगा या छोटा।
(d) तत्व A किस प्रकार के आयन धनायन या ऋणायन बनाएगा?
उत्तर:
(a) A अधातु है।
(b) A की अपेक्षा C कम क्रियाशील है।
(c) C का साइज B से छोटा होगा।
(d) A ऋणायन बनाएगा।
उत्तर: N 7 = 2, 5; P 15 = 2, 8, 5
नाइट्रोजन तत्व फॉस्फोरस तत्व से अधिक ऋण विद्युती होगा, क्योंकि इस समूह में ऊपर से नीचे जाने पर तत्वों की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम होती जाती है।
उत्तर:- तत्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्वों की स्थिति से गहरा सम्बन्ध है। कोशों की कुल संख्या से तत्व का आवर्त निर्धारित होता है और संयोजी इलेक्ट्रॉनों से तत्व का समूह निर्धारित होता है।
उत्तर:- परमाणु संख्या 12 एवं 38 वाले तत्वों के भौतिक एवं रासायनिक गुणधर्म कैल्सियम के समान
उत्तर: - आधुनिक दीर्घाकार आवर्त सारणी में उपसमूह A और B को अलग-अलग कर दिया गया जिससे मैण्डलीफ की आवर्त सारणी में भिन्न गुणों वाली क्षार धातुएँ तथा क्षारीय मुद्रा धातुएँ अलग-अलग हो गईं। इस प्रकार यह विसंगति दूर हो गई। इस सारणी में कुल 18 समूह बनाए गए जिसमें उत्कृष्ट तत्वों (अक्रियशील गैसों) को पृथक् 18वाँ समूह मिल गया। आधुनिक आवर्त सारणी का आधार परमाणु द्रव्यमान के स्थान पर परमाणु क्रमांक को दिया गया जिससे समस्थानिकों एवं समभारिकों की विसंगतियाँ दूर हो गईं तथा भारी तत्वों के पहले आने की विसंगति भी स्वयं दूर हो गई है। शेष हाइड्रोजन, एक्टिनाइड श्रेणी एवं लैन्थेनाइड श्रेणी की यथास्थिति है। सभी बाद में खोजे गए तत्वों को इस सारणी मंल उपयुक्त स्थान मिल चुका है। इससे 6 के स्थान पर 7 आवर्त हैं।
परीक्षोपयोगी अतिरिक्त प्रश्नोत्तर (वस्तुनिष्ठ प्रश्न)
(a) ऑक्सीजन।
(b) कैल्सियम।
(c) कोबाल्ट।
(d) पोटैशियम।
उत्तर: (b) कैल्सियम।
(a) बढ़ते परमाणु क्रमांक।
(b) घटते परमाणु क्रमांक।
(c) बढ़ते परमाणु द्रव्यमान।
(d) घटते परमाणु द्रव्यमान।
उत्तर:- (c) बढ़ते परमाणु द्रव्यमान।
(a) जर्मेनियम।
(b) क्लोरीन।
(c) ऑक्सीजन।
(d) सिलिकॉन।
उत्तर:- (a) जर्मेनियम।
(i) आधुनिक आवर्त तालिका में तत्वों को उनके घटते परमाणु क्रमांक के क्रम में व्यवस्थित किया गया है।
(ii) आधुनिक आवर्त तालिका में तत्वों को उनके बढ़ते परमाणु द्रव्यमान के क्रम में व्यवस्थित किया गया है।
(iii) आवर्त तालिका में समस्थानिकों को आसन्न समूहों में रखा गया है।
(iv) आधुनिक आवर्त तालिका में तत्वों को उनके बढ़ते परमाणु क्रमांक के क्रम में रखा गया है।
(a) केवल (i)
(b) (i), (ii) एवं (iii)
(c) (i), (ii) एवं (iv)
(d) केवल (iv)।
उत्तर:- (b) (i), (ii) एवं (iii)
(a) इसमें 18 क्षैतिज पंक्तियाँ हैं जो आवर्त कहलाते हैं।
(b) इसमें 7 ऊर्ध्वाधर स्तम्भ हैं जो आवर्त कहलाते हैं।
(c) इसमें 18 ऊर्ध्वाधर स्तम्भ हैं जो समूह कहलाते हैं।
(d) इसमें 7 क्षैतिज पंक्तियाँ हैं जो समूह कहलाती हैं।
उत्तर:- (c) इसमें 18 ऊर्ध्वाधर स्तम्भ हैं जो समूह कहलाते हैं।
(a) A, B, C
(b) B, C, D
(c) A, D, E
(d) B, D, E
उत्तर:- (b) B, C, D
(a) A एवं B
(b) B एवं D
(c) A एवं C
(d) D एवं E
उत्तर:- (c) A एवं C
(a) समूह 8
(b) समूह 2
(c) समूह 18
(d) समूह 10
उत्तर:- (c) समूह 18
(a) समूह 1 से।
(b) समूह 14 से।
(c) समूह 15 से।
(d) समूह 16 से।
उत्तर:- (b) समूह 14 से।
(a) K कोश।
(b) L कोश।
(c) M कोश।
(d) N कोश।
उत्तर:(b) L कोश।
(a) Na
(b) Al
(c) Si
(d) P
उत्तर: (d) P
(a) O, F, N
(b) N, F, O
(c) O, N, F
(d) F, O, N
उत्तर: (d) F, O, N
(a) Na
(b) Mg
(c) K
(d) Ca
उत्तर: (c) K
(a) Mg
(b) Na
(c) K
(d) Ca
उत्तर: (c) K
(a) Na
(b) F
(c) Mg
(d) Al
उत्तर: (b) F
(i) एक तत्व के सभी समस्थानिकों के परमाणु द्रव्यमान समान होते हैं।
(ii) एक तत्व के सभी समस्थानिकों के परमाणु क्रमांक समान होते हैं।
(iii) एक तत्व के सभी समस्थानिक समान भौतिक गुणों का प्रदर्शन करते हैं।
(iv) एक तत्व के सभी समस्थानिक समान रासायनिक गुणों का प्रदर्शन करते हैं।
(a) (i), (ii) एवं (iii)
(b) (ii), (iii) एवं (iv)
(c) (ii) एवं (iii)
(d) (i) एवं (iv)
उत्तर: (d) (i) एवं (iv)
(a) Cl > Si >Al > Mg > Na
(b) Na > Mg >Al > Si > Cl
(c) Na > Al > Mg > Cl > Si
(d) Al > Na > Si > Ca > Mg
उत्तर: (b) Na > Mg >Al > Si > Cl
(a) F < O < C < Be < Li
(b) Li < Be < C < O < F
(c) F < O < C < Be < Li
(d) F < O < Be < C < Li
उत्तर:- (b) Li < Be < C < O < F
प्रश्न 19.ऐकाऐलुमिनियम किस प्रकार का ऑक्साइड बनाता है?
(a) EO3
(b) E3O2
(c) E2O3
(d) EO
उत्तर:-(c) E2O3
प्रश्न 20.तीन तत्व B, Si एवं Ge हैं –
(a) धातु।
(b) अधातु।
(c) उपधातु।
(d) क्रमश: धातु. अधातु एवं उपधातु।
उत्तर:-(c) उपधातु
प्रश्न 21.निम्न में से कौन-सा तत्व अम्लीय ऑक्साइड बनाता है?
(a) परमाणु क्रमांक 7 वाला तत्व।
(b) परमाणु क्रमांक 3 वाला तत्व।
(c) परमाणु क्रमांक 12 वाला तत्व।
(d) परमाणु क्रमांक 19 वाला तत्व।
उत्तर:- (a) परमाणु क्रमांक 7 वाला तत्व।
प्रश्न 22.परमाणु क्रमांक 14 वाला तत्व कठोर है तथा अम्लीय ऑक्साइड एवं सहसंयोजी हैलाइड बनाता है। वह तत्व निम्नलिखित में से किस वर्ग का तत्व है?
(a) धातु।
(b) उपधातु।
(c) अधातु।
(d) वामहस्त तत्व।
उत्तर:- (b) उपधातु।
प्रश्न 23. निम्न में से कौन एक तत्व की सही परमाणु त्रिज्या को प्रदर्शित करता है?
(b) (ii) एवं (iii)
(c) (iii) एवं (iv)
(d) (i) एवं (iv)
उत्तर:- (b) (ii) एवं (iii)
(a) परमाणु त्रिज्या।
(b) धात्विक प्रवृत्ति।
(c) संयोजकता।
(d) कोशों की संख्या।
उत्तर:- (c) संयोजकता।
(a) बढ़ता है।
(b) घटता है।
(c) परिवर्तित नहीं होता।
(d) पहले बढ़ता है फिर घटता है।
उत्तर:- (b) घटता है।
(a) Be, Mg, Ca
(b) Na, Li, K
(c) Mg, Al, Si
(d) C, O, N
उत्तर:- (a) Be, Mg, Ca
(a) 4
(b) 6
(c) 7
(d) 8
उत्तर:- (c) 7
(a) ब्रोमीन।
(b) क्लोरीन।
(c) फ्लुओरीन।
(d) आयोडीन।
उत्तर:- (c) फ्लुओरीन।
रिक्त स्थानों की पूर्ति
- “मैण्डलीफ के आवर्त नियम के अनुसार तत्वों के भौतिक एवं रासायनिक गुण उनके ….. के आवर्ती फलन होते हैं।”
- आधुनिक आवर्त नियम के अनुसार, तत्वों के भौतिक एवं रासायनिक गुण उनके ………… के आवर्ती फलन होते हैं।
- दीर्घ रूप आवर्त सारणी को ………. आवर्त सारणी कहते हैं।
- आवर्त सारणी में ऊर्ध्वाधर स्तम्भ …………. कहलाते हैं।
- आवर्त सारणी में क्षैतिज पंक्तियाँ ……….. कहलाती हैं।
- आधुनिक आवर्त सारणी में ………… समूह हैं।
- परमाणु द्रव्यमान।
- परमाणु क्रमांक।
- आधुनिक।
- समूह (ग्रुप)।
- आवर्त।
- अट्ठारह (18)।
जोड़ी बनाइए :-
स्तम्भ अ स्तम्भ ब
- त्रिक नियम (a) मोजले
- अष्टक नियम (b) अक्रिय गैसें
- आवर्त नियम (c) डोबेराइनर
- आधुनिक आवर्त नियम (d) न्यूलैण्ड
- 18 वें समूह के तत्व (e) मैण्डलीफ
- → (c)
- → (d)
- → (e)
- → (a)
- → (b)
सत्य/असत्य कथन
- क्षैतिज पंक्तियाँ समूह कहलाती हैं।
- समूह एक के तत्व क्षार धातुएँ कहलाती हैं।
- ऊर्ध्वाधर स्तम्भ आवर्त कहलाते हैं।
- समूह 17 के तत्व हेलोजेन कहलाते हैं।
- समूह 2 के तत्व मुद्रा धातुएँ कहलाती हैं।
- असत्य।
- सत्य।
- असत्य।
- सत्य।
- असत्य।
एक शब्द/वाक्य में उत्तर
- आवर्त तालिका का निर्माण किसने किया?
- आधुनिक आवर्त तालिका का निर्माण किसने किया?
- समूह 2 के तत्वों को क्या कहा जाता है?
- प्रथम आवर्त में कितने तत्व हैं?
- द्वितीय आवर्त में कितने तत्व हैं?
- मैण्डलीफ।
- बोर एवं बरी ने।
- क्षारीय मृदा धातुएँ।
- दो।
- आठ।
अति लघु उत्तरीय प्रश्न
उत्तर:- डोबेराइनर का त्रिक नियम:-
डोबेराइनर ने समान गुण रखने वाले तत्वों को उनके बढ़ते परमाणु द्रव्यमान के क्रम में तीन-तीन के समूह बनाए जिन्हें ‘डोबेराइनर के त्रिक’ कहते हैं। उसने एक नियम दिया जिसके अनुसार “यदि समान गुणों वाले तत्वों को उनके बढ़ते परमाणु द्रव्यमान के क्रम में तीन-तीन के समूह में व्यवस्थित किया जाए तो बीच वाले तत्व का परमाणु द्रव्यमान शेष दो तत्वों के परमाणु द्रव्यमान का लगभग औसत होता है।”
उत्तर: न्यूलैण्ड का अष्टक नियम:
“यदि तत्वों को उनके बढ़ते परमाणु द्रव्यमान के क्रम में व्यवस्थित किया जाए तो हर आठवाँ तत्व समान गुण रखता है।”
उत्तर: - मैण्डलीफ का आवर्त नियम-“तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्ती फलन होते हैं।”
उत्तर:- मैण्डलीफ की आवर्त सारणी-“मैण्डलीफ ने तत्वों को एक सारणी में उनके गुणों एवं परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया जिसमें 7 क्षैतिज पंक्तियाँ हैं जिन्हें आवर्त कहते हैं तथा 9 ऊर्ध्व स्तम्भ हैं जिन्हें समूह (वर्ग) कहते हैं (यद्यपि प्रारम्भ में 8 वर्ग थे, लेकिन बाद में अक्रिय गैसों का शून्य समूह और जोड़ दिया गया) यह सारणी मैण्डलीफ की आवर्त सारणी कहलाती है।”
उत्तर:- आधुनिक आवर्त नियम:-
मोजले ने एक नियम का प्रतिपादन किया जिसके अनुसार, “तत्वों के भौतिक एवं रासायनिक गुण उनके परमाणु क्रमांक के आवर्ती फलन होते हैं।” यह नियम आधुनिक आवर्त नियम कहलाता है।
उत्तर:- चूँकि आधुनिक आवर्त सारणी तत्वों के परमाणु क्रमांकों पर आधारित है और समस्थानिकों के परमाणु क्रमांक समान हैं। इसलिए उनको एक ही समूह में रखना औचित्यपूर्ण है।
उत्तर:- प्रथम समूह के तत्व क्षार धातुएँ तथा द्वितीय समूह के तत्व क्षारीय मृदा धातुओं के नाम से जाने जाते हैं।
उत्तर:- किसी आवर्त में बाएँ से दाएँ जाने पर आयनन ऊर्जा में वृद्धि होती है।
उत्तर:- तत्वों की उपर्युक्त व्यवस्था डोबेराइनर के त्रिक नाम से जानी जाती है। उदाहरण-लीथियम, सोडियम एवं पोटैशियम।
(a) तत्वों के समान गुणों वाले दो समूहों का चयन कीजिए।
(b) तत्वों की व्यवस्था का क्रम तत्वों के वर्गीकरण के किस नियम को प्रदर्शित करता है?
उत्तर:
(a)
- F एवं Cl
- Na एवं K
उत्तर:- यद्यपि आवर्त तालिका का सृजन परमाणु द्रव्यमान के बढ़ते क्रम के आधार पर किया गया, लेकिन गुणों की समानता और उनकी क्रमबद्धता को भी ध्यान में रखा गया इसलिए कोबाल्ट को निकैल से पहले रखा गया।
उत्तर:- हाइड्रोजन प्रथम समूह के तत्व क्षार धातुओं एवं 17वें समूह के तत्व हैलोजेनों से गुणों में समानता रखता है। इसलिए इसका आधुनिक आवर्त तालिका में विशिष्ट स्थान है।
उत्तर:- मैण्डलीफ के द्वारा भविष्यवाणी किए गए तत्व क्रमशः एका-सिलिकॉन जरमेनियम Ge है जिसकी संयोजकता 4 है तथा एका-ऐलुमिनियम गैलियम Ga है जिसकी संयोजकता 3 है। अत: इनके क्लोराइड के सूत्र क्रमश: GeCl4 एवं GaCl3 होंगे।
उत्तर:- चूँकि तत्व X समूह 14 में रखा गया है। अतः इसकी संयोजकता 14 – 10 = 4 होगी। इसलिए इसके क्लोराइड का सूत्र XCl4 होगा तथा इसके बन्धों की प्रकृति सहसंयोजी होगी।
- X में 12 प्रोटॉन एवं 12 इलेक्ट्रॉन हैं।
- Y में 12 प्रोटॉन एवं 10 इलेक्ट्रॉन हैं।
उत्तर: Ge < Ga < Mg < Ca < K.
उत्तर:- संयोजकता:-
“किसी तत्व की दूसरे किसी तत्व से संयुक्त होने की प्रवृत्ति उस तत्व की संयोजकता कहलाती है।” दूसरे शब्दों में, “इलेक्ट्रॉनों की वह संख्या जो किसी तत्व के परमाणु द्वारा स्थायी संरचना प्राप्त करने हेतु दी या ली जाती है अथवा साझा की जाती है, उस तत्व की संयोजकता कहलाती है।”
लघु उत्तरीय प्रश्न
(a) इनके परमाणुओं में इलेक्ट्रॉनों की संख्या।
(b) इनके परमाणुओं का साइज।
(c) इनकी धात्विक प्रकृति।
(d) इनकी इलेक्ट्रॉन त्यागने की प्रवृत्ति।
(e) इनके ऑक्साइडों के सूत्र।
(f) इनके क्लोराइडों के सूत्र।
उत्तर: तत्व ‘P’ एवं ” के दिए हुए लक्षणों/गुणधर्मों के आधार पर तुलना –
- परमाणु में इलेक्ट्रॉन संख्या - 'P' की अपेक्षा 'Q' में एक इलेक्ट्रॉन अधिक
- परमाणु साइज - 'P' का परमाणु साइज 'Q' से अधिक
- धात्विक प्रवृति - 'P' की धात्विक प्रवृत्ति 'Q' से अधिक
- इलेक्ट्रॉन त्यागने की प्रवृत्ति - 'P' की इलेक्ट्रॉन त्यागने की प्रवृत्ति 'Q' से अधिक
- ऑक्साइड़ों के सूत्र - P2O एवं QO जहॉ P एवं Q दिए तत्व हैं।
- क्लोराइड़ों के सूत्र - PCl एवं Qcl2 जहॉ P एवं Q दिए तत्व हैं।
उत्तर:- परमाणु क्रमांक 16 वाले तत्व का इलेक्ट्रॉनिक विन्यास 2, 8, 6 है –
- तत्व के इलेक्ट्रॉनिक विन्यास में उपस्थित कोशों (कक्षाओं) की संख्या उस तत्व का आधुनिक आवर्त तालिका में आवर्त की संख्या को निर्धारित करती है। जैसे उक्त तत्व का आवर्त 3 है।
- प्रथम आवर्त होने पर अर्थात् केवल एक कोश होने पर यदि संयोजी इलेक्ट्रॉन एक है तो प्रथम समूह और यदि दो संयोजी इलेक्ट्रॉन हैं तो समूह 18 होगा।द्वितीय अथवा तृतीय आवर्त अर्थात् दो अथवा तीन कोश होने पर संयोजी इलेक्ट्रॉन 1 से 8 तक क्रमशः प्रथम, द्वितीय, 13वाँ, 14वाँ, 15वाँ, 16वाँ, 17वाँ एवं 18वाँ, समूह होगा। यहाँ परमाणु संख्या 16 का विन्यास 2, 8, 6 है जो तृतीय आवर्त का तत्व है तथा संयोजी इलेक्ट्रॉन 6 है इसलिए यह 16वें समूह का तत्व है।
- परमाणु क्रमांक से उसका इलेक्ट्रॉनिक विन्यास ज्ञात करने पर यदि संयोजी इलेक्ट्रॉन (बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या) यदि 4 या इससे कम है तो वही संख्या उसकी संयोजकता होगी। यदि 5 या 5 से अधिक है तो उस संख्या में से 8 घटाने पर प्राप्त संख्या ही उसकी संयोजकता होगी।
(a) ‘X’ में संयोजकता इलेक्ट्रॉनों की संख्या तथा इसकी संयोजकता निर्धारित कीजिए।
(b) ‘X’ की हाइड्रोजन के साथ अभिक्रिया द्वारा बने यौगिक का अणुसूत्र लिखिए तथा इसकी इलेक्ट्रॉन बिन्दु संरचना खींचिए।
(c) तत्व ‘X’ का नाम लिखिए तथा उल्लेख कीजिए कि यह तत्व धातु है अथवा अधातु है।
उत्तर:
चूँकि तत्व ‘X’ आधुनिक आवर्त सारणी के तृतीय आवर्त एवं 16वें समूह का तत्व है। इसलिए इसकी परमाणु संख्या एवं इलेक्ट्रॉन संख्या 16 है जिसका इलेक्ट्रॉन विन्यास 16 = 2, 8, 6 है।
(a) ‘X’ में संयोजकता इलेक्ट्रॉनों की संख्या = 6
एवं संयोजकता = 6 – 8 = – 2
(b) ‘X’ की हाइड्रोजन के साथ बने यौगिक का अणुसूत्र = H2X
(c) तत्व X का नाम = सल्फर (S)
यह एक अधातु तत्व है।
उत्तर:- चूँकि ‘X’ की द्रव्यमान संख्या A = 35 एवं न्यूट्रॉनों की संख्या n = 18 अत: उसकी परमाणु संख्या Z = A – n
⇒ Z = 35 – 18 = 17
इलेक्ट्रॉनों की संख्या = द्रव्यमान संख्या = 17
इलेक्ट्रॉन विन्यास 17 = 2, 8, 7
X की समूह संख्या = 17
X की आवर्त संख्या = 3
X की संयोजकता = 7 – 8 = – 1
- किसी आवर्त में बायीं ओर से दायी ओर जाने पर तथा
- किसी समूह में ऊपर से नीचे आने पर तत्वों के धात्विक अभिलक्षणों में किस प्रकार का परिवर्तन होता है? अपने उत्तर की कारण सहित पुष्टि कीजिए।
- किसी आवर्त में बाईं ओर से दाईं ओर जाने पर धात्विक अभिलक्षणों का ह्रास होता है अर्थात् कमी आती है।
- किसी समूह में ऊपर से नीचे की ओर जाने पर धात्विक अभिलक्षणों में वृद्धि होती है।
(a) संयोजकता अधिकतम
(b) परमाणु त्रिज्या अधिकतम
(c) रासायनिक अभिक्रियाशील अधिकतम है?
प्रत्येक के लिए कारण सहित अपने उत्तर की पुष्टि कीजिए।
उत्तर:- चूँकि Na, Mg एवं Al तृतीय आवर्त के क्रमशः समूह 1, 2 एवं 13 के तत्व हैं। इसलिए इनका परमाणु क्रमांक क्रमश: 11, 12 एवं 13 है, जिनका इलेक्ट्रॉन विन्यास निम्नलिखित है
Na = 11 = 2, 8, 1 में संयोजी इलेक्ट्रॉन = 1 अर्थात् संयोजकता = 1
Mg = 12 = 2, 8, 2 में संयोजी इलेक्ट्रॉन = 2 अर्थात् संयोजकता = 2
Al= 13 = 2, 8, 3 में संयोजी इलेक्ट्रॉन = 3 अर्थात् संयोजकता = 3
अतः
(a) अधिकतम 3 संयोजकता वाला तत्व Al है, क्योंकि इसके संयोजकता कोश में सर्वाधिक संयोजी इलेक्ट्रॉन है।
(b) अधिकतम परमाणु त्रिज्या वाला तत्व Na है, क्योंकि किसी आवर्त में बाएँ से दाएँ जाने पर उसका साइज अर्थात् परमाणु त्रिज्या कम होती जाती है।
(c) अधिकतम अभिक्रियाशीलता वाला तत्व Na है, क्योंकि किसी आवर्त में 14वें समूह तक अभिक्रियाशीलता घटती है।
(a) Na, Si, Cl
(b) Be, Mg, Ca.
परमाणु द्रव्यमान क्रमशः Be = 9, Na = 23, Mg = 24, Si = 28, Cl= 35 एवं Ca = 40 हैं। सहित व्याख्या कीजिए।
उत्तर:- (a) नहीं, क्योंकि ये तत्व समान गुणों वाले नहीं हैं, जबकि डोबेराइनर के त्रिक के लिए समान गुणों वाले तत्व होने चाहिए। यद्यपि सिलिकॉन (Si) का परमाणु द्रव्यमान सोडियम (Na) एवं क्लोरीन (Cl) के परमाणु द्रव्यमानों के औसत के लगभग बराबर है।
(b) हाँ, ये डोबेराइनर के त्रिक के रूप में वर्गीकृत किए जा सकते हैं, क्योंकि ये समान गुणों वाले तत्व हैं तथा Be एवं Ca के परमाणु द्रव्यमानों क्रमशः 9 एवं 40 का औसत द्रव्यमान
(a) Li, Be, F, N
(b) Cl, At, Br, I.
उत्तर:- (a) चूँकि तत्व Li, Be, F एवं N एक ही आवर्त द्वितीय के तत्व हैं जिनका बाएँ से दाएँ क्रम है Li, Be, N एवं F और चूँकि किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या (परमाणु साइज) घटती जाती है।
अतः परमाणु त्रिज्या का बढ़ता क्रम F < N < Be < Li है।
(b) चूँकि तत्व Cl, At, Br एवं I एक ही समूह 17 के तत्व हैं जिनका ऊपर से नीचे क्रम है Cl, Br, I एवं At और चूँकि किसी समूह में ऊपर से नीचे जाने पर परमाणु त्रिज्या (परमाणु साइज) बढ़ती जाती है।
अतः परमाणु त्रिज्या का बढ़ता क्रम Cl < Br < I < At है।
(a) 2, 8, 2
(b) 2, 8, 1
(c) 2, 8, 7
(d) 2, 1
उत्तर:- उपर्युक्त में धातु तत्व हैं –
(a) 2, 8, 2
(b) 2, 8, 1
(d) 2, 1
इनके नाम हैं –
(a) मैग्नीशियम।
(b) सोडियम।
(d) लीथियम।
उत्तर: A तत्व का इलेक्ट्रॉन विन्यास 19 = 2, 8, 8, 1
एवं B तत्व का इलेक्ट्रॉन विन्यास 17 = 2, 8, 7
बनने वाले यौगिक का सूत्र = AB
बनने वाले आबन्ध की प्रकृति सहसंयोजी है।
(a) एक तत्व जो मुलायम एवं अधिक अभिक्रियाशील है।
(b) चूना पत्थर की महत्वपूर्ण घटक धातु।
(c) कमरे के ताप पर द्रव अवस्था में रहने वाली धातु।
उत्तर:
(a) सोडियम (Na) अथवा पोटैशियम (K)।
(b) कैल्सियम (Ca) एवं
(c) मरकरी (Hg)।
अभिक्रियाशीलता के आरोही (बढ़ते हुए) क्रम में Hg < Ca < Na < K
(a) एक धातु जो मुलायम है तथा मिट्टी के तेल में रखी जाती है।
(b) एक परिवर्तनीय (एक से अधिक) संयोजकता वाला तत्व जो जल के अन्दर रखा जाता है।
(c) एक चतुसंयोजी तत्व जो कार्बनिक रसायन को आधार प्रदान करता है।
(d) परमाणु संख्या 2 वाला अक्रिय गैस तत्व।
(e) एक तत्व जिसके ऑक्साइड की पतली सतह दूसरे तत्व को एनोडाइजिंग प्रक्रिया के द्वारा संक्षारण रहित बनाती है।
उत्तर:
(a) सोडियम (Na) आवर्त तालिका के तृतीय आवर्त एवं प्रथम समूह का तत्व। अथवा पोटैशियम (K) आवर्त तालिका के चतुर्थ आवर्त एवं समूह एक का तत्व।
(b) फॉस्फोरस (P) तृतीय आवर्त एवं 15वें समूह का तत्व।
(c) कार्बन (C) द्वितीय आवर्त एवं 14वें समूह का तत्व।
(d) हीलियम (He) प्रथम आवर्त एवं समूह 18 का तत्व।
(e) ऐलुमिनियम (Al) तृतीय आवर्त एवं 13वें समूह का तत्व।
उत्तर:-उत्कृष्ट या अक्रिय गैसें।
मैण्डलीफ के आवर्त वर्गीकरण में परमाणु द्रव्यमान को तत्वों के भौतिक एवं रासायनिक गुणों का आवर्ती फलन का आधार लेते हुए उनके भौतिक एवं रासायनिक गुणों को ध्यान में रखते हुए आवर्त तालिका में व्यवस्थित किया। उत्कृष्ट गैसें अक्रिय होने के कारण एक पृथक् समूह में रखी जाती है और जिससे वास्तविक व्यवस्था में कोई व्यवधान नहीं होता।
उत्तर:- मैण्डलीफ द्वारा तत्वों के वर्गीकरण के समय मात्र 63 तत्व ज्ञात थे इन्हीं तत्वों के गुणों के आधार पर निम्न प्रकार उसने तत्वों का वर्गीकरण किया –
- इन तत्वों के ऑक्सीजन एवं हैलोजेनों के साथ बने यौगिकों, ऑक्साइड एवं हैलाइड का अध्ययन किया।
- समान गुणों वाले तत्वों को एक साथ एक वर्ग में रखा।
- मैण्डलीफ ने प्रेक्षण किया कि तत्व स्वत: ही बढ़ते हुए परमाणु द्रव्यमान के क्रम में व्यवस्थित हो गए। इस प्रकार मैण्डलीफ ने आवर्त नियम की व्यवस्था की।
दीर्घ उत्तरीय प्रश्न
(a) उस तत्व की पहचान कीजिए।
(b) उस तत्व का इलेक्ट्रॉन विन्यास लिखिए।
(c) जब यह तत्व वायु की उपस्थिति में जलता है तो उस समय होने वाली अभिक्रिया का रासायनिक सूत्र लिखिए।
(d) जब यह ऑक्साइड जल में घुलता है तो होने वाली अभिक्रिया का रासायनिक सूत्र लिखिए।
(e) इस ऑक्साइड के बनने का इलेक्ट्रॉन बिन्दु आरेख बनाइए।
उत्तर:
(a) उक्त तत्व मैग्नीशियम (Mg) है।
(b) मैग्नीशियम (Mg) का इलेक्ट्रॉन विन्यास
(a) X और Y तत्वों को आवर्त तालिका में कहाँ रखा गया है?
(b) तत्व X एवं Y को धातु, अधातु एवं उपधातु में वर्गीकृत कीजिए।
(c) तत्व Y के ऑक्साइड की प्रकृति कैसे होगी? बनने वाले यौगिक में आबन्ध की प्रकृति बताइए।
(d) द्वि-संयोजी हैलाइड का इलेक्ट्रॉन बिन्दु-आरेख खींचिए।
उत्तर:
(a) X आवर्त तालिका के समूह 17 एवं आवर्त तृतीय का तत्व है, जबकि Y समूह 2 के चतुर्थ आवर्त का तत्व है।
(b) X एक अधातु तत्व है एवं Y एक धातु तत्व है।
(c) ऑक्साइड क्षारकीय प्रकृति का है तथा इसमें बनने वाले आबन्ध की प्रकृति विद्युत् संयोजी (आयनिक) बन्ध है।
(d) द्वि-संयोजी हैलाइड का इलेक्ट्रॉन बिन्दु आरेख
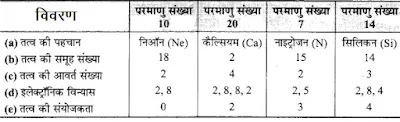
(a) इन तत्वों की पहचान कीजिए।
(b) इन तत्वों के आवर्त सारणी में समूहों की पहचान कीजिए।
(c) इन तत्वों के आवर्त सारणी में आवों की पहचान कीजिए।
(d) इन तत्वों में प्रत्येक का इलेक्ट्रॉन विन्यास क्या होना चाहिए?
(e) इन तत्वों की संयोजकता ज्ञात कीजिए।
(a) उन तत्वों के नाम लिखिए जिन्होंने इन तत्वों का स्थान ग्रहण किया।
(b) आधुनिक आवर्त तालिका में इन तत्वों की समूह संख्या एवं आवर्त संख्या लिखिए।
(c) इन तत्वों को धातु/अधातु/उपधातु में वर्गीकृत कीजिए।
(d) इनमें से प्रत्येक में कितने संयोजी इलेक्ट्रॉन हैं।
प्रश्न 5.
(a) तत्वों की विद्युत् धनात्मकता समूह में नीचे जाने पर बढ़ती है तथा आवर्त में दाएँ जाने पर घटती है।
(b) तत्वों की विद्युत् ऋणात्मकता समूह में नीचे जाने पर घटती है तथा आवर्त में दाएँ जाने पर बढ़ती है।
(c) परमाणु साइज समूह में नीचे जाने पर बढ़ती है तथा आवर्त में दाएँ जाने पर घटती है।
(d) धात्विक प्रकृति (धात्विकता) समूह में नीचे जाने पर बढ़ती है तथा आवर्त में दाएँ जाने पर घटती है।
आवर्त तालिका के उपर्युक्त लक्षणों को ध्यान में रखकर परमाणु संख्या 3 से 9 के तत्वों के सन्दर्भ में निम्न प्रश्नों के उत्तर दीजिए
(i) उनमें अधिकतम इलेक्ट्रो-धनात्मक तत्व का नाम बताइए।
(ii) उनमें अधिकतम इलेक्ट्रो-ऋणात्मक तत्व का नाम बताइए।
(iii) उनमें न्यूनतम परमाणु साइज वाले तत्व का नाम बताइए।
(iv) उस तत्व का नाम बताइए जो उपधातु है।
(v) उस तत्व का नाम बताइए जिसकी संयोजकता सर्वाधिक है।
उत्तर:
(i) लीथियम (Li) परमाणु संख्या: 3
(ii) फ्लु ओरीन (F) परमाणु संख्या: 9
(iii) फ्लु ओरीन (F) परमाणु संख्या: 9
(iv) बोरॉन (B) परमाणु संख्या: 5
(v) कार्बन (C) परमाणु संख्या: 6, क्षमता संयोजकता (4)
प्रश्न 6. एक पीला एवं कमरे के ताप पर ठोस तत्व श्रृंखलन क्षमता एवं बहरूपता के गुण प्रदर्शित करता है। X तत्व दो प्रकार के ऑक्साइड बनाता है जो फेरस सल्फेट के क्रिस्टलों के ऊष्मीय अपघटन के समय भी बनते हैं एवं बहुत बड़े वायु प्रदूषक भी हैं।
(a) तत्व X की पहचान कीजिए।
(b) तत्व X का इलेक्ट्रॉन विन्यास लिखिए।
(c) फेरस सल्फेट के क्रिस्टलों के ऊष्मीय अपघटन में होने वाली अभिक्रिया का संतुलित समीकरण लिखिए।
(d) बनने वाले ऑक्साइड की प्रकृति (अम्लीय/क्षारकीय) क्या है?
(e) आधुनिक आवर्त तालिका में उस तत्व की स्थिति बताइए।
उत्तर:
(a) अभीष्ट तत्व X सल्फर (S) है जिसकी परमाणु संख्या 16 है।
(b) X का इलेक्ट्रॉन विन्यास 16 = 2K, 8L, 6M
(d) X के दोनों ऑक्साइड (SO2 एवं SO3) की प्रकृति अम्लीय है।
(e) आधुनिक आवर्त तालिका में तत्व X की स्थिति तृतीय आवर्त के समूह 16 में है।
प्रश्न 7.आवर्त तालिका के समूह 15 का एक तत्व X द्वि-परमाण्विक अणु के रूप में रहता है एवं हाइड्रोजन से 773 K तापमान पर उत्प्रेरक की उपस्थिति में संयोग करके एक यौगिक अमोनिया का निर्माण करता है जिसकी विशिष्ट तीव्र गंध होती है।
(a) उस तत्व X की पहचान कीजिए। इसमें कितने संयोजी इलेक्ट्रॉन हैं।
(b) तत्व X के द्वि-परमाण्विक अणु की इलेक्ट्रॉन बिन्दु संरचना बनाइए। इसमें किस प्रकार का आबन्ध बनता है ?
(c) अमोनियम के अणु की इलेक्ट्रॉन बिन्दु संरचना का आरेख बनाइए। अमोनिया में किस प्रकार के आबन्ध हैं।
उत्तर:
(a) तत्व X नाइट्रोजन (N) तत्व है, जिसका इलेक्ट्रॉन विन्यास 2, 5 है अतः इसके संयोजी इलेक्ट्रॉन की संख्या 5 है।
(b) नाइट्रोजन अणु (N) की इलेक्ट्रॉन बिन्दु संरचना का आरेख –
आबंधों की प्रकृति – त्रिसहसंयोजी आबन्ध।
(c) अमोनिया (NH3) की इलेक्ट्रॉन बिन्दु संरचना का आरेख –
आबन्धों की प्रकृति – तीन एकल सहसंयोजी आबन्ध।
____________________________
To download the PDF file of this chapter, click on the button given below.
बटन पर क्लिक करे।
Click on the button.
5 सेकेण्ड़ के बाद डाउनलोड बटन ओपन होगा।
After 5 seconds the download button will open.
डाउनलोड़ बटन पर क्लिक करे।
Click on the download button.
10 सेकण्ड के बाद पीडीएफ फाईन ओपन होगी।
After 10 seconds the PDF will open fine.














0 Comments:
Post a Comment
Write any question or suggestion.